4. СОЛИ
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков.
Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень:
NaCI ® Na+ + CI -
Al2(SO4)3 ® 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот. Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-.
Кислые соли диссоциируют ступенчато:
KH2PO4 ® K+ + H2PO4-,
H2PO4- ![]() H+
+ HPO42-,
H+
+ HPO42-,
HPO42- ![]() H+
+ PO43-,
H+
+ PO43-,
Кислые соли чаще всего образуются в избытке кислоты:
Mg(OH)2 + 2H2SO4 ![]() Mg(HSO4)2 + 2H2O.
Mg(HSO4)2 + 2H2O.
кислая соль
Mg(OH)2 + H2SO4 ![]() MgSO4
+ 2H2O
MgSO4
+ 2H2O
средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями. Гидроксиды щелочных металлов основных солей не имеют.
Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4.
Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+:
Cr(OH)2CI,
CrOHCI2,
(Cr(OH)2)2SO4,
CrOHSO4,
(Cr(OH)2)3PO4,
(CrOH)3(PO4)2.
Основные соли диссоциируют ступенчато:
CuOHNO3 ® CuOH+ + NO3- (первая ступень),
CuOH+ ![]() Cu2+ + OH-
(вторая ступень).
Cu2+ + OH-
(вторая ступень).
Основные соли образуются в избытке основания:
2Cu(OH)2 + H2SO4 ![]() (CuOH)2SO4 + 2H2O
(CuOH)2SO4 + 2H2O
основная соль
Cu(OH)2 + H2SO4 ![]() CuSO4 + 2H2O
CuSO4 + 2H2O
средняя соль
Номенклатура солей:
1. Средние соли бескислородных кислот.
Название данных солей образуется следующим образом.
В начале называется анион, названия одноатомных анионов образуются из корней латинских названий соответствующих элементов с суффиксом «ид» (Cl - – хлорид, F - – фторид, S2- – сульфид), затем называется катион. Одноатомные катионы обозначаются русским названием элемента в родительном падеже. Если элемент имеет переменную валентность, то она указывается в названии. Например:
NaCl – хлорид натрия;
Са3Р2 – фосфид кальция;
Fe2S3 – сульфид железа (III).
2. Средние соли кислородсодержащих кислот.
Названия анионов кислородосодержащих кислот составляются из корня латинского названия элемента, образующего кислоту, с добавлением суффиксов: «ат» (когда кислотообразующий элемент проявляет высшую степень окисления):
+6 +5
(SO4)2- – сульфат, (NO3)- – нитрат;
«ит» (когда кислотообразующий элемент проявляет низшую степень окисления):
+4 +3
(SO3)2- – сульфит, (NO2)- – нитрит.
 Название
катионов описано выше.
Название
катионов описано выше.
+6
Na2SO4 – сульфат натрия;
+5
К3 РО4 – фосфат калия;
+2 +5
Cu(NO3)2 - нитрат меди (II);
+1 +5
CuNO3 - нитрат меди (I);
+4
CaSO3 - сульфит кальция;
+3
AI(NO2)3 - нитрит алюминия;
+2
Fe(NO2)2 - нитрит железа (II).
Если данный кислотообразующий элемент образует кислоты более, чем в двух степенях окисления, то суффикс «ат» применяется во всех названиях атомов кислот, русские названия которых содержат суффиксы «оватая», «овая» и «ная». При этом к названию аниона, в котором кислотообразующий элемент имеет высшую степень окисления добавляется приставка «пер». Так, анион хлорноватой кислоты:
+5
ClО3- – называется хлорат-ион, а анион хлорной кислоты:
+7
ClО4- – перхлорат-ион.
В названиях анионов кислот, русские названия которых содержат суффиксы «оватистая» и «истая», используется суффикс «ит». К названию же аниона, в котором кислотообразующий элемент имеет низшую степень окисления, добавляется приставка «гипо». Так, анион хлористой кислоты ClO2- – называется хлорит-ион, а хлорноватистый ClO-– гипохлорит-ион.
|
Кислородосодержащие кислоты хлора |
Соли |
|
HСlO – хлорноватистая кислота |
KСlO – гипохлорит калия |
|
HСlO2 – хлористая кислота |
KСlO2 – хлорит калия |
|
HClO3 – хлорноватая кислота |
KСlO3 – хлорат калия |
|
HClO4 – хлорная кислота |
KClO4 – перхлорат калия |
Если в названии кислоты используются приставки «мета», «орто» и другие, то и в названии соли они сохраняются: НРО3 – метафосфорная кислота, КРО3 – метафосфат калия,
H3PO4 - ортофосфорная кислота, K3PO4 - ортофосфат калия.
В названиях анионов кислых солей с одним атомом водорода содержится приставка «гидро» (от латинского названия водорода Hydrogenium – гидрогениум). Если же в кислотном остатке несколько атомов водорода, то в названии кислой соли сохраняется приставка «гидро», но с греческим числительным, показывающим число атомов водорода в анионе:
NaHSO4 – гидросульфат натрия;
Са(НСО3)2 – гидрокарбонат кальция;
FeНРО4 – гидрофосфат железа (II);
КН2РО4 – дигидрофосфат калия;
Fe(Н2РО4)3 – дигидрофосфат железа (Ш).
В состав катионов основных солей входят катион соответствующего металла и группа ОН-, которой дано сложное название, состоящее из корня латинского названия водорода «гидро» и слова «оксид»: гидроксид – ион, или гидроксо – «группа». Причем в названиях сдвоенные буквы «О» превращаются в одну. Число ОН- – групп в сложном катионе указывается греческим числительным:
ZnOHCl – хлорид гидроксоцинка;
FeOHSO4 – сульфат гидроксожелеза (III);
[Al(OH)2]2SO4 – сульфат дигидроксоалюминия;
SnOHNO3 – нитрат гидроксоолова (II).
При составлении формул придерживаются следующих правил:
по суффиксу в названии средней соли определяют какой кислоты соль: бескислородной или кислородсодержащей.
Например:
1. Хлорид натрия: «ид» показывает, что это соль бескислородной кислоты с анионом Cl-. Катионом является Na+. Записываем сначала катион, затем анион Na+Cl-. Катион и анион однозарядны, индексы не используются.
2. Сульфид алюминия: Al3+S2- истинная формула Al2S3, молекула электронейтральна.
3. Сульфат железа (III): «ат» показывает, что это соль кислородсодержащей кислоты, в которой сера в максимальной степени окисления. Это анион SO42-. Катион железа – Fe3+. Записываем сначала катион и анион, а затем индексы, выравнивающие число положительных и отрицательных зарядов: Fe3+(SO4)2- - истинная формула Fe2(SO4)3.
По названию кислой соли определяют, какой кислоты соль (бескислородной или кислородсодержащей) и сколько атомов водорода входит в состав сложного атома. Далее поступают как при составлении формул средних солей.
Например:
1. Гидросульфид железа (III). Соль бескислородной сероводородной кислоты. Анион содержит один атом водорода НS- , катион Fe2+. Записываем катион, сложный анион и индексы: Fe2+(HS)-, следовательно формула будет Fe(HS)2.
2. Дигидрофосфат кальция. Соль кислородсодержащей фос-форной кислоты. Сложный анион содержит два («ди») атома водорода, катион Са2+. Записываем Са2+(Н2РО4)-. Ставим индексы: Са(Н2РО4)2. Молекула электронейтральна.
По названию основной соли определяют, какой кислоты данная соль и сколько гидроксогрупп входит в состав сложного катиона. Записывают сложный катион, затем анион и индексы, уравнивающие заряды. Если металл имеет переменную валентность, то она указывается в названии соли. Например:
1. Хлорид гидроксотитана (IV),
(ТiОН)3+Cl - – правильная формула TiOHCl3.
2. Нитрат дигидроксокобальта (III)
(Сo(OH)2)+NO3- – правильная формула Сo(OH)2NO3.
Классификация солей по следующим признакам:
1. По растворимости:
рстворимые – KCI, Ba(NO3)2, CuSO4,
нерастворимые– BaSO4, AgCI, Ca3(PO4)2.
2.По свойствам:
cредние или нормальные – Na2SO4, MgCI2,
кислые – KHSO4, Ca(H2PO4)2,
основные – CuOHCI, AI(OH)2NO3.
Получение
1. Взаимодействие металла с неметаллом:
Fe + ![]() FeS
FeS
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот:
Zn + H2SO4 ![]() ZnSO4 + H2
ZnSO4 + H2![]()
3. Взаимодействие металлов с растворами солей:
Fe + CuSO4 ![]() FeSO4 + Cu.
FeSO4 + Cu.
4. Взаимодействие кислот с основаниями (реакция нейтрализации):
HCI + NaOH ![]() NaCI + H2O.
NaCI + H2O.
5. Взаимодействие кислот с основными оксидами:
H2SO4 + CaO ![]() CaSO4 + H2O.
CaSO4 + H2O.
6. Взаимодействие кислот с растворами солей:
H2SO4 + BaCI2 ![]() BaSO4
BaSO4![]() +
2HCI.
+
2HCI.
7. Взаимодействие оснований с растворами солей:
2NaOH + CuSO4 ![]() Cu(OH)2
Cu(OH)2![]() +
Na2SO4.
+
Na2SO4.
8. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 ![]() CaCO3
CaCO3![]() +
H2O.
+
H2O.
9. Взаимодействие основных оксидов с кислотами:
CaO + CO2 ![]() CaCO3
CaCO3![]()
10. Взаимодействие растворов солей с неметаллами:
2KBr + CI2 ![]() 2KCI + Br2.
2KCI + Br2.
11. Взаимодействие растворов солей между собой:
NaCI + AgNO3 ![]() AgCI
AgCI![]() +
NaNO3.
+
NaNO3.
12. Получение солей аммония:
NH3 + HCI ![]() NH4CI.
NH4CI.
Химические свойства
1. Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее, чем металл, входящий в состав соли:
Zn + FeSO4 ![]() ZnSO4 + Fe.
ZnSO4 + Fe.
2.Растворимые в воде соли взаимодействуют с основаниями:
CuSO4 + 2NaOH ![]() Cu(OH)2
Cu(OH)2![]() +
Na2SO4,
+
Na2SO4,
KHSO4 + KOH ![]() K2SO4 + H2O.
K2SO4 + H2O.
3. Соли взаимодействуют с растворами кислот:
CaCI2 + H2SO4 ![]() CaSO4
CaSO4![]() +
2HCI,
+
2HCI,
Ca(HCO3)2 + 2HCI ![]() CaCI2
+ H2O + CO2
CaCI2
+ H2O + CO2![]()
MgOHCI + HCI ![]() MgCI2 + H2O.
MgCI2 + H2O.
4.Водные растворы солей взаимодействуют между собой с образованием новых солей:
BaCI2 + Na2SO4 ![]() BaSO4
BaSO4![]() +
2NaCI,
+
2NaCI,
Ca(HCO3)2 + Na2CO3
![]() CaCO3
CaCO3![]() +
2NaHCO3.
+
2NaHCO3.
5. Растворы солей взаимодействуют с неметаллами:
2NaI + Br2 ![]() 2NaBr + I2
2NaBr + I2![]()
6. Многие соли при нагревании разлагаются, особенно
легко – карбонаты:
CaCO3 ![]() CaO + CO2
CaO + CO2![]()
(CuOH)2CO3
![]() CuO + CO2
CuO + CO2![]() +
H2O,
+
H2O,
2NaHCO3 ![]() Na2CO3 +
CO2
Na2CO3 +
CO2![]() +
H2O.
+
H2O.
7. Некоторые соли взаимодействуют с водой с образованием кристаллогидратов:
CuSO4 + 5H2O ® CuSO4 . 5 Н2О.
белый цвет голубой цвет
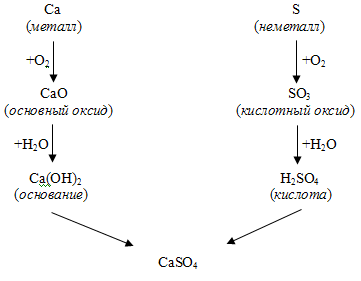
Основные классы неорганических соединений связаны между собой. Генетической связью между ними считают тот факт, что из неорганических соединений одного класса можно получить соединение другого класса. Иногда это можно сделать в одну стадию, иногда – в несколько:
Лабораторная работа № 4
Химические свойства солей и способы их получения
Цель работы: ознакомиться с химическими свойствами солей и способами их получения. Освоить работу с аппаратом Киппа.
Посуда и реактивы: аппарат Киппа, пробирки, микрошпатель, спиртовка, фильтровальная бумага, фарфоровая чашка. Растворы сульфата меди, серной кислоты, иодида калия, нитрата серебра, хлорида никеля, кобальта, бария, щелочи, гидроксида кальция, порошок серы, железные опилки, кусочки цинка.
Ход работы:
Опыт № 1. Взаимодействие металла с неметаллом
В пробирку поместить один микрошпатель железных опилок и один микрошпатель порошка серы. Тщательно перемешать и подогреть на спиртовке, зажав пробирку в держателе. Убедитесь, что реакция сопровождается выделением большого количества тепла, соблюдая правила техники безопасности. Пробирку охладить и содержимое ее перенести на лист фильтровальной бумаги. Полученное вещество однородно и имеет черный цвет. Написать уравнение реакции и назвать полученную соль.
Опыт № 2. Взаимодействие металла с кислотой
В пробирку налить 2–3 см3 разбавленной серной кислоты и бросить кусочек цинка. Наблюдается бурная реакция с выделением пузырьков газа (водорода) и образованием соли, в чем можно убедиться, выпарив несколько капель содержимого пробирки в фарфоровой чашке. Написать уравнение реакции. Уравнять методом электронного баланса.
Опыт № 3. Взаимодействие металла с раствором соли
В голубой раствор сульфата меди (II) опустить 2–3 кусочка гранулированного цинка, нагреть жидкость до кипения и перемешивать ее до обесцвечивания. Наблюдать выделение красного металла. Написать уравнение реакции, сделать выводы.
Опыт № 4. Взаимодействие неметалла с раствором соли
Внести в пробирку 3–4 см3 раствора иодида калия и прилить несколько капель хлорной воды. Выпадает черный осадок мелкодисперсного иода. Написать уравнение реакции и указать, какая соль образовалась.
Опыт № 5. Взаимодействие соли с кислотой
Смешать в пробирке немного раствора нитрата серебра с разбавленной соляной кислотой. Наблюдается выделение белого творожистого осадка. Эта реакция является качественной на катион серебра Ag+ и анион СI - .Написать уравнения реакций.
Опыт № 6. Взаимодействие соли с основанием
В две пробирки налить небольшое количество хлоридов никеля (II) и кобальта (II). Добавить в обе пробирки 5–6 капель раствора гидроксида натрия. Отметить цвет выпавших осадков и указать, какие соли при этом образовались. Написать уравнения реакций.
Опыт № 7. Взаимодействие солей между собой
К раствору хлорида бария в пробирке прилить раствор сульфата калия.
К раствору нитрата бария прилить раствор сульфата магния.
В обоих случаях наблюдается выпадение белого осадка. Эта реакция является качественной на катион Ba2+ и анион SO42
Какая соль выпадает в осадок и какие соли образуются в растворе в первом и во втором случае?
Опыт № 8. Образование кислой соли
Налить в пробирку 3–4 см3 известкового молока Ca(OH)2 и пропустить в раствор оксид углерода (IV) из аппарата Киппа. Наблюдать выпадение осадка средней соли, затем продолжить пропускать углекислый газ до растворения осадка. Растворение осадка объясняется образованием кислой соли (растворимость ее больше, чем средней) Ca(HCO3)2. Написать уравнения реакций.
Опыт № 9. Образование основной соли
В две пробирки внести по 6–8 капель разбавленного раствора сульфата меди (II). В одну пробирку быстро добавить избыток раствора щелочи. Наблюдать образование ярко-голубого осадка гидроксида меди (II).
В другую пробирку разбавленный раствор щелочи прибавлять по каплям. В этом случае образуется светло-голубой осадок основной соли (CuOH)2SO4. Написать уравнение реакций и назвать образовавшиеся соли в обеих пробирках.