
ВОРОНЕЖСКАЯ ГОСУДАРСТВЕННАЯ ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ
Ю.С. ПЕРЕГУДОВ, И.В. КУЗНЕЦОВА, С.И. НИФТАЛИЕВ
(дизайн - студентка гр.М-095 М.А. Плотникова)
ХИМИЧЕСКИЙ
СЛОВАРЬ – СПРАВОЧНИК

Воронеж
2009
СПИСОК ТЕРМИНОВ
ОПРЕДЕЛЕНИЯ
АКТИНОИДЫ – четырнадцать химических элементов от тория Th до лоуренсия Lr (порядковые номера 90-103), это f-элементы, так как в атомах этих элементов происходит заполнение 5f-орбитали.
АЛЛОТРОПИЯ – явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам. Различные простые вещества, образованные одним и тем же элементом, называются аллотропными модификациями. Например, элемент кислород образует два простых вещества: кислород О2 и озон О3; аллотропные модификации элемента углерода – алмаз, графит, карбин, аморфный углерод – кокс, древесный уголь, сажа, активированный уголь.
АМФОТЕРНЫЕ ГИДРОКСИДЫ (ОСНОВАНИЯ) – электролиты, образующие при диссоциации в водном растворе одновременно катионы H+ и анионы ОН-, то есть, диссоциирующие по типу кислоты и основания: Zn(OH)2 , Al(OH)3 , Cr(OH)3 ,
по типу кислот: H2ZnO2↔2H++ZnO22-
по типу оснований: Zn(OH)2 ↔ 2OH -+Zn2+
АНГИДРИДЫ КИСЛОТ – кислотные оксиды, чтобы их получить, надо от кислоты отнять столько воды, чтобы полностью удалить водород, при этом останется кислотный оксид соответствующей кислоты. Можно найти иначе, зная, что степень окисления среднего элемента в кислоте и соответствующем ангидриде одинакова:
![]() ,
,
![]() .
.
АТОМ – наименьшая частица химического элемента, входящая в состав простых и сложных веществ, являющаяся носителем свойств элемента. Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Атом химически неделим.
АТОМ ВОЗБУЖДЕННЫЙ – состояние атома, в котором он имеет большую энергию, чем в основном состоянии.
АТОМНАЯ МАССА ОТНОСИТЕЛЬНАЯ(Аr)
– масса атома, выраженная в атомных
единицах массы (а.е.м.). Это величина, которая показывает, во сколько раз масса
атома данного элемента больше 1/12 массы атома углерода изотопа
![]() .
Современные значения относительных атомных масс приведены в Периодической
системе Д.И. Менделеева (указаны среднеарифметические значения атомных масс для
природной смеси изотопов этих элементов).
.
Современные значения относительных атомных масс приведены в Периодической
системе Д.И. Менделеева (указаны среднеарифметические значения атомных масс для
природной смеси изотопов этих элементов).
АТОМНЫЙ НОМЕР – порядковый номер химического элемента в периодической системе элементов, равен числу протонов, входящих в состав атомных ядер данного элемента.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ является фундаментом современного естествознания. Начало этому учению было положено атомистикой Левкиппа и Демокрита (V век до нашей эры). Дальнейшее развитие получило в работах Эпикура (IV век до нашей эры), который ввел понятие о массе атомов. Настоящее возрождение науки начинается в XVI – XVII веках. П. Гассенди ввел понятие о молекуле, Р. Бойль впервые применил понятие «химический элемент».
Наибольший вклад внес в создание атомно-молекулярного учения М. В. Ломоносов. В 1741 г. он сформулировал основные положения этого учения.
Позднее оно было дополнено работами Дж. Дальтона, Ж. Л. Гей-Люссака, А. Авогадро.
В настоящее время основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами существуют расстояния, размеры которых зависят от агрегатного состояния вещества, от температуры и давления.
3. Молекулы находятся в непрерывном движении.
4. Между молекулами существуют силы притяжения и отталкивания.
5. Молекулы состоят из атомов, которые также находятся в постоянном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических - разрушаются.
8. У веществ с молекулярным строением в твердом состоянии в узлах кристаллической решетки находятся молекулы.
9. У веществ с немолекулярным строением в твердом состоянии в узлах кристаллической решетки находятся атомы или ионы.
ВАЛЕНТНОСТЬ – способность атомов элементов образовывать химические связи. Количественной мерой валентности является число связей, образованных данным атомом с другими атомами или другими атомными группами. Атом водорода может образовывать только одну связь, поэтому его валентность была принята за единицу. Валентность других элементов можно выразить числом, показывающим, сколько атомов водорода может присоединить атом данного элемента.
IV I
CH4 HCl.
Например,валентность углерода в метане равна четырем. Численное значение валентности принято обозначать римскими цифрами:
В настоящее время валентность определяется как число ковалентных связей, которыми данный атом соединен с другими. Например, атом азота имеет три неспаренных электрона и в молекуле азота он трехвалентен:
:N::N:
ВЕЩЕСТВО – вид материи, имеющий массу покоя, отличную от нуля. Простое вещество состоит из атомов одного элемента: кислород O2, хлор Cl2, сера S, железо Fe. Сложное вещество состоит из атомов различных элементов: вода H2O, азотная кислота HNO3, оксид магния MgO.
ВОДОРОДНАЯ СВЯЗЬ - химическая связь, образованная положительно поляризованным водородом одной молекулы (или полярной группы) и электроотрицательным атомом другой или той же молекулы. Водородная связь между разными молекулами называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами обозначается тремя точками:
F-H+F-H→F-H∙∙∙F-H
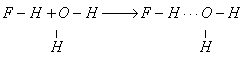
Образование водородной связи обусловлено тем, что в полярных молекулах или полярных группах поляризованный атом водорода обладает следующими свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома. Образование межмолекулярных водородных связей приводит к повышению вязкости, температур кипения и плавления, теплот плавления и парообразования веществ (вода, фтороводород, аммиак). Вещества с внутримолекулярными водородными связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры кипения и плавления.
ВОДОРОДНЫЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ:
а) летучие, их образуют элементы IV-VII групп главных подгрупп. Чтобы определить валентность элемента по водороду, надо от цифры VIII, по числу групп, отнять номер группы, где находится данный элемент:
|
IV |
I |
|
III |
I |
|
I |
I |
|
I |
II |
|
C H4, |
|
N H3 |
|
H Cl, |
|
H2 S |
||||
б) нелетучие, их образуют металлы I-III групп главных подгрупп, например, гидрид натрия NaH, гидрид калия KH.
ВОССТАНОВЛЕНИЕ – присоединение атомом, ионом или молекулой электронов, сопровождающееся понижением степени окисления. Например:
S0+2![]() =S
-2 ; Cl2+2
=S
-2 ; Cl2+2![]() =2Cl
- ; Fe+3+1
=2Cl
- ; Fe+3+1![]() =Fe+2.
=Fe+2.
ВОССТАНОВИТЕЛИ – атомы, ионы или молекулы, отдающие электроны в процессе ОВР. К восстановителям относятся металлы, H2, C, CO, NH3, H2S, HCl, FeSO4 и др.
ГИБРИДИЗАЦИЯ – явление смешения орбиталей различной формы и энергии и образование такого же числа новых орбиталей одинаковой формы и энергии (sp, sp2, sp3, sp3d, sp3d2 и других).
ГИДРОЛИЗ СОЛЕЙ – взаимодействие ионов соли с водой, приводящее к образованию слабодиссоциирующих веществ:
а) гидролиз солей, образованных катионом сильного основания и анионом слабой кислоты, идет по аниону, реакция среды – щелочная:
Na2S+HOH↔NaHS+NaOH;
2Na++S2-+HOH↔Na++HS - +Na++OH -;
S2-+HOH↔HS -+OH -.
б) гидролиз солей, образованных катионом слабого основания и анионом сильной кислоты, протекает по катиону, реакция среды – кислая:
FeCl3+HOH↔FeOHCl2+HCl;
Fe3++3Cl -+HOH↔FeOH2++2Cl -+H++Cl -;
Fe3++HOH↔FeOH2++H+;
в) гидролиз солей, образованных катионом слабого основания и анионом слабой кислоты, протекает и по катиону и по аниону, реакция среды в растворах таких солей зависит от относительной силы кислоты и основания, может быть нейтральной, слабощелочной или слабокислой в зависимости от соотношения констант диссоциации, образующихся кислот и оснований:
CH3COONH4+HOH↔CH3COOH+NH4OH;
CH3COO-+NH4++HOH↔CH3COOH+NH4OH.
К1(NH4OH)=6,3·10-5
K2(CH3COOH)=1,75·10-5
Реакция среды – слабощелочная, так как К1>К2.
Al2S3+6HOH→2Al(OH)3↓+3H2S↑.
г) соли, образованные катионом сильного основания и анионом сильной кислоты гидролизу не подвергаются, так как нет взаимодействия ионов соли с водой, реакция среды – нейтральная, например, K2SO4, NaNO3, Na2SO4, KCl;
д) совместный гидролиз солей:
2AlCl3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑+6NaCl,
CuSO4+Na2CO3+H2O=Cu(OH)2↓+CO2↑+Na2SO4.
В результате обменной реакции между исходными веществами, образуется соль, полностью гидролизующаяся.
ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО (n – номер энергетического уровня) – характеризует запас энергии электрона на данном энергетическом уровне. Чем дальше электроны находятся от положительно заряженного ядра, тем большим запасом энергии они обладают, n принимает значения натурального ряда чисел от 1 до ∞.
ГРУППА – совокупность элементов с одинаковым числом валентных электронов, равным номеру группы:
а) главная подгруппа – элементы, имеющие s- и р-валентные электроны; с увеличением порядкового номера усиливаются металлические свойства элементов, число электронов на внешнем энергетическом уровне совпадает с номером группы;
б) побочная подгруппа – элементы, имеющие валентные s,d- или f-электроны. Все элементы побочных подгрупп – металлы;
в) физический смысл группы – высшая валентность элемента по кислороду, за исключением, например, фтора, кислорода, азота, железа, никеля и других.
ДИПОЛЬ – электрически нейтральная система с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) друг от друга.
ДЛИНА СВЯЗИ – межъядерное расстояние между химически связанными атомами.
ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ возможен за счет электронной пары одного атома или иона (донора) и валентной орбитали другого атома или иона (акцептора)
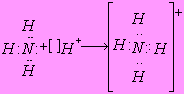
|
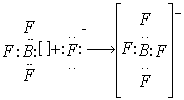
|
ЗАКОН АВОГАДРО: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем.
При нормальных условиях (T=273 К, p=105 Па) 1 моль любого газа занимает объем 22,4 дм3 (22,4 л). Этот объем называется молярным объемом газа (VM).
VM=22,4 дм3/моль
ЗАКОН ДЕЙСТВУЮЩИХ МАСС: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Например, для
реакции 2NO+O2
![]() 2NO2,
закон действующих
масс запишется так:
2NO2,
закон действующих
масс запишется так:
![]() =kС2(NO)·С(O2),
=kС2(NO)·С(O2),
где k – константа скорости, зависящая от природы реагирующих веществ и температуры. Скорость в реакциях с участием твердых веществ определяется только концентрацией газов или растворенных веществ:
С+О2=СО2,
![]() =kCO2
=kCO2
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА сформулирован Ж. Прустом в 1808 г.: всякое чистое вещество молекулярного строения имеет постоянный качественный и количественный состав независимо от способа его получения.Состав соединений с немолекулярной структурой (с атомной, ионной, металлической решеткой) не является постоянным и зависит от условий получения.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВА сформулирован (1748 г.) и экспериментально подтвержден (1756 г.) М.В. Ломоносовым: Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции
![]() +
+![]() =
=![]() +
+![]()
Является частью всеобщего закона сохранения массы и энергии.Значение закона состоит в следующем:
1. Его открытие положило начало химии как точной науки.
2. На основании этого закона производятся расчеты по химическим уравнениям.
ЗАРЯД ЯДРА(Z) – число протонов в ядре, он равен атомному номеру (порядковому номеру элемента в периодической таблице).
ЗНАКИ ХИМИЧЕСКИЕ - изображение химических элементов посредством символов. Химический знак образован от латинского названия элемента. Используется первая буква или первая и одна из последуюших букв:
|
Русское название элемента |
Латинское название элемента |
Химический знак |
|
Кислород |
Oxygenium |
O |
|
Водород |
Hydrogenium |
H |
|
Кальций |
Calcium |
Ca |
|
Медь |
Cuprum |
Cu |
Около символа элемента могут быть указаны: массовое число (вверху слева от знака), число протонов в ядре (внизу слева от знака), заряд иона (вверху справа от знака):
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
ИЗОТОПЫ –
разновидности атомов химических элементов, ядра
которых содержат одинаковое число протонов, но различное число нейтронов (Z
одинаково, N
различно): ![]()
ИНГИБИТОР – вещество, замедляющее химическую реакцию (отрицательный катализатор). Например, ингибиторы коррозии (NaNO3, K2Cr2O7).
ИОНЫ – атомы или группы атомов, несущие положительный (катионы) или отрицательный (анионы) заряд, они подразделяются на:
б) сложные (OH-, SO42-, NH4+, PO43-);
в) комплексные ([Al(OH)4]-, [Ag(NH3)2]+).
ИОНЫ ГИДРАТИРОВАННЫЕ – ионы электролита, связанные с молекулами воды:
Cl-·nH2O (гидратированный анион),
Na+·nH2O (гидратированный катион).
ИОН ГИДРОКСОНИЯ – ион водорода, связанный с молекулой воды по донорно-акцепторному механизму:
![]()
ИОННЫЕ РЕАКЦИИ – реакции между ионами в растворах электролитов, они протекают до конца в сторону образования
· Осадков,
· Газов,
· Слабых электролитов.
Их записывают с помощью сокращенных ионных уравнений, показывающих, какие ионы (и молекулы) реагируют друг с другом:
а) реакция нейтрализации – реакция между ионами Н+ и ОН -, в результате которой образуется слабый электролит – вода.
2NaOH+H2SO4=Na2SO4+2H2O – молекулярное уравнение реакции.
2Na++2OH-+2H++SO42-=2Na++SO42-+2H2O – полное ионное уравнение реакции.
OH-+H+=H2O – сокращенное ионное уравнение реакции;
б) реакция обмена – реакция между катионами и анионами, которые входят в состав молекул взаимодействующих электролитов, и сопровождается образованием трудно растворимых соединений, газообразных веществ или слабого электролита, например, воды. Реакция нейтрализации – частный случай реакции обмена.
CaCl2+Na2CO3=CaCO3↓+2NaCl,
Ca2++2Cl-+2Na++CO32-=CaCO3↓+2Na++2Cl-,
Ca2++CO32-=CaCO3↓,
Na2CO3+2HCl=2NaCl+H2O+ +CO2↑,
2Na++CO32-+2H++2Cl- =2Na++2Cl-+H2O+CO2↑,
CO32-+2H+=H2O+CO2↑;
в) реакция замещения – реакция, при которой катионы или анионы обмениваются электронами с атомами.
2KI+Cl2=2KCl+I2,,
2K++2I-+Cl2=2K++2Cl-+I2,,
2I-+Cl2=2Cl-+I2,
Fe+CuSO4=FeSO4+Cu,
Fe+Cu2++SO42-=Fe2++SO42-+Cu,
Fe+Cu2+=Fe2++Cu.
ИОННАЯ СВЯЗЬ представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности электроотрицательностей атомов, например между катионами s-металлов I и II групп периодической системы и анионами VI и VII групп (NaCl, K2O, NaH и другие). Ионная связь не обладает насыщенностью, не имеет направленности.
КАТАЛИЗ – изменение скорости химической реакции в присутствии веществ, называемых катализаторами.
КАТАЛИЗАТОРЫ – вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Реакции, протекающие в присутствии катализаторов, называются каталитическими.
При положительном катализе скорость реакции возрастает, при отрицательном (ингибирование) – убывает.
Примером положительного катализа может служить процесс окисления аммиака на платине при производстве азотной кислоты.
Примером отрицательного катализа – снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, хромата или дихромата калия.
При гомогенном катализе катализатор находится в той же фазе, что и реагирующие вещества. Примером может служить разложение пероксида водорода в присутствии йодид-ионов:
H2O2+I-=H2O+IO-,
H2O+IO-=H2O+I-+O2,
При гомогенном катализе катализатор образует с реагирующими веществами промежуточное соединение, что приводит к снижению энергии активации:
![]() ,
,
![]() ,
,
![]() .
.
При гетерогенном катализе катализатор образует самостоятельную фазу. Реагирующие вещества адсорбируются на поверхности твердого катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности.
Примером такого катализа является окисление оксида серы (IV) в оксид серы (VI) на катализаторе V2O5 при производстве серной кислоты:
![]() .
.
Катализаторы обладают селективностью, т. е. изменяют скорость одной или небольшого числа реакций.
Многие промышленные процессы, а также большинство биохимических процессов в живых организмах являются каталитическими.
КИСЛОТЫ – электролиты, при диссоциации которых в водном растворе образуются катионы водорода и анионы кислотного остатка:
H2SO4⇆H++HSO4-⇆H++SO42-
HNO3→H++NO3-
а) по числу атомов водорода, способных к отщеплению в водном растворе:
· одноосновные (HF, HCl, HNO3, HBr)
· двухосновные (H2SO4, H2CO3, H2SO3, H2S)
· многоосновные (H3PO4, H4P2O7, H3BO3)
б) по составу:
· кислородсодержащие (HNO3, HMnO4, HNO2, H3PO4).
· бескислородные (HCl, H2S, HF).
а) амфотерные – оксиды, обладающие свойствами кислотных и основных оксидов, им соответствуют гидратные соединения, относящиеся как к классу кислот, так и к классу оснований:
![]() Zn(OH)2
Zn(OH)2
ZnO H2ZnO2,,
![]() Al(OH)3
Al(OH)3
Al2O3 H3AlO3(HAlO2);
![]() б)
кислотные – оксиды неметаллов или переходных металлов в высокой степени
окисления, которым соответствуют кислоты:
б)
кислотные – оксиды неметаллов или переходных металлов в высокой степени
окисления, которым соответствуют кислоты:
MnO3→H2MnO4, Mn2O7→HMnO4, CrO3→H2CrO4.
![]() HPO3
HPO3
P2O5 H3PO4
H4P2O7
Кислотные оксиды называют «ангидридами кислот» (см. ангидриды кислот).
в) несолеобразующие (безразличные) – оксиды, не образующие солей в результате химических реакций: NO, SO, H2O, N2O.
г) основные – оксиды типичных металлов, гидратные соединения которых относятся к классу оснований:
CaO→Ca(OH)2, Na2O→NaOH, CuO→Cu(OH)2.
КЛАССИФИКАЦИЯ ОСНОВАНИЙ по растворимости:
а) нерастворимые (Cu(OH)2, Fe(OH)3, Fe(OH)2);
б) малорастворимые (Ca(OH)2, Sr(OH)2);
в) растворимые в воде сильные основания называют щелочами (NaOH, KOH).
КОВАЛЕНТНАЯ СВЯЗЬ – связь между атомами, осуществляемая путем образования общих электронных пар. Электроны внешней оболочки, участвующие в образовании связи, могут изображаться точками (формула Льюиса), а связи – черточками. Например,
молекулы HI O2 N2
связь H-I O=O N≡N
формула H:I
![]()
Льюиса
:N![]()
![]() N:
N:
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ – связь между атомами с одинаковой электроотрицательностью путем обобществления электронов (H2, Cl2, O2, N2).
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ - связь между атомами с разной по значению электроотрицательностью за счет обобществления электронов (HCl, HBr, NH3).
КОНСТАНТА ДИССОЦИАЦИИ (КДИСС) – величина, характеризующая способность электролита диссоциировать на ионы: чем больше значение КДИСС, тем легче электролит распадается на ионы, тем больше ионов в его растворе и тем сильнее электролит. Например,
КДИСС(CH3COOH)=1,75·10-5,
KДИСС(HCN)=6,2·10-10, это означает, что уксусная кислота (CH3COOH) является более сильным электролитом, чем синильная кислота (HCN).
КОНЦЕНТРАЦИЯ РАСТВОРА – это масса или количество растворенного вещества, содержащегося в определенной массе или объеме раствора.
Способы выражения концентрации растворов: массовая доля, мольная доля, молярность, молярная концентрация эквивалента и др.
КРИСТАЛЛОГИДРАТЫ – это твердые кристаллические вещества, в состав которых входят молекулы воды: CuSO4·5H2O, CaSO4·2H2O. При растворении веществ в воде происходит их взаимодействие с молекулами воды. Образуются гидраты. Химическая связь в гидратах может быть настолько прочной, что не разрушается даже при выпаривании раствора.
ЛАНТАНОИДЫ – семейство из 14 химических элементов III группы 6-го периода периодической системы (атомные номера 58-71), по мере увеличения заряда ядра происходит заполнение 4f-орбитали.
МАССОВАЯ ДОЛЯ (![]() )
РАСТВОРЕННОГО ВЕЩЕСТВА – это величина,
равная отношению массы растворенного вещества к массе раствора:
)
РАСТВОРЕННОГО ВЕЩЕСТВА – это величина,
равная отношению массы растворенного вещества к массе раствора:
![]() ,
или
,
или ![]() .
.
МАССОВОЕ ЧИСЛО ЯДРА (А) – общее число протонов и нейтронов:
А=Z+N.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ – связь между атом-ионами металлов, находящимися в узлах кристаллической решетки, осуществляемая свободными электронами. Эта связь осуществляется в кристаллах металлов и сплавов и определяет основные общие свойства металлов: пластичность, теплопроводность, электропроводимость.
МОЛЕКУЛА – наименьшая частица вещества, обладающая всеми его химическими свойствами и способная существовать самостоятельно. Из молекул состоят газообразные вещества, многие жидкости(вода, спирт), твердые вещества с молекулярной структурой кристаллической решетки. Вещества с молекулярной структурой имеют низкие температуры плавления и кипения
МОЛЕКУЛЯРНАЯ МАССА АБСОЛЮТНАЯ (mM) -mM
=![]() ,
,
где M – молярная масса вещества, NА – постоянная Авогадро (NA = 6,02 1023 моль-1).
МОЛЕКУЛЯРНАЯ МАССА ОТНОСИТЕЛЬНАЯ (Мr) –
масса молекулы, выраженная в атомных единицах
массы (а.е.м.). Она показывает, во сколько раз масса молекулы данного вещества
больше 1/12 массы атома углерода изотопа
![]() С.
Относительная молекулярная масса вещества равна сумме относительных атомных масс
атомов, входящих в состав молекулы.
С.
Относительная молекулярная масса вещества равна сумме относительных атомных масс
атомов, входящих в состав молекулы.
МОЛЬ – количество вещества,содержащее
столько структурных единиц (молекул, атомов, ионов, электронов и др.), сколько
атомов содержится в 0,012 кг (12 г) изотопа углерода
![]() С,
а именно 6,02·1023. Величина 6,02 1023 моль-1
относится к фундаментальным физическим постоянным и называется постоянной
Авогадро.
С,
а именно 6,02·1023. Величина 6,02 1023 моль-1
относится к фундаментальным физическим постоянным и называется постоянной
Авогадро.
МОЛЯРНАЯ КОНЦЕНТРАЦИЯ (c) – это отношение
количества растворенного вещества (![]() )
к объему раствора: Единица молярной
концентрации моль/дм3 (моль/л).
)
к объему раствора: Единица молярной
концентрации моль/дм3 (моль/л).
![]()
![]()
МОЛЯРНАЯ МАССА (М) – масса одного моля
вещества. Это величина, равная отношению массы вещества (m)
к соответствующему количеству (![]() ):
):
М =
![]()
![]()
Единицы измерения молярной массы г/моль или кг/моль. Молярная масса численно равна относительной молекулярной массе вещества: молярная масса воды М(Н2О) = 18 г/моль, Мr(Н2О) = 18.
МОЛЯРНЫЙ ОБЪЕМ ГАЗА – см. закон Авогадро.
НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ обусловлена определенными ориентациями атомных орбиталей в пространстве. В зависимости от направления перекрывания атомных орбиталей различают σ-,π-,δ- связи. Сигма-связь – связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов. Сигма-связь может возникать при перекрывании s-s, s-px, px-px, d-d, d-s, d-p, s-q, p-q, q-q орбиталей (q –гибридная орбиталей. Пи-связь – связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания). Пи-связь может образовываться при перекрывании p-p, p-d, d-d орбиталей . Дельта-связь – связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками.
НАСЫЩЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ обусловлена тем, что в химическом взаимодействии участвует ограниченное число электронов.
НЕЙТРОН (n) – элементарная частица, входящая в состав ядра атома. Заряд 0, относительная масса 1. Открыт Дж. Чедвиком в 1932 году.
НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ – реакции, протекающие в одном направлении до полного израсходования одного из исходных веществ.
НЕЭЛЕКТРОЛИТЫ – вещества, которые не распадаются на ионы в растворе, имеющие неполярную связь , например, многие органические вещества.
НУКЛОНЫ – общее название протонов и нейтронов, из которых построены все атомные ядра.
ОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
– реакции, протекающие во взаимно противоположных направлениях. Особенностью
таких реакций является то, что в системе присутствуют все исходные вещества и
продукты реакции. Уравнения обратимых реакций записываются с помощью
специального знака ![]()
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ. Для составления уравнений ОВР необходимо провести подбор коэффициентов методом электронного баланса или методом электронно-ионного баланса. Эти методы основаны на том, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Например:


3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O.
ОКИСЛЕНИЕ – отдача атомом, ионом или молекулой электронов, сопровождающееся повышением степени окисления. Например:
|
|
|
|
ОКИСЛИТЕЛИ – атомы, ионы, молекулы, присоединяющие электроны в процессе ОВР. К окислителям относятся неметаллы (галогены, кислород), кислоты (HNO3, H2SO4), кислородсодержащие соли, в которых есть элементы в высшей степени окисления (KMnO4, K2Cr2O7, K2CrO4, KNO3,), оксиды (MnO2, PbO2).
ОКСИДЫ – сложные вещества, состоящие из двух химических элементов, одним из которых является кислород, и не содержащие цепочки из атомов кислорода: Na2O, Al2O3, H2O, CO2, P2O5, Cu2O.
ОСНОВАНИЯ – это электролиты, которые при диссоциации в водном растворе образуют только один вид анионов – гидроксид-ионы ОН-:
NaOH⇆Na++OH-,
Ba(OH)2⇆Ba2++2OH-.
ПЕРИОД – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом, кроме Н, Не – элементов первого периода.
ПЕРИОДИЧЕСКИЙ ЗАКОН (Д.И. Менделеев, 1869 г.) – свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атома (современная формулировка).
Свойства простых тел по периоду меняются от типичного металла к типичному неметаллу, а свойства их соединений, например, характер оксидов меняется от основного (Na2O) к кислотному (Cl2O7), через амфотерный (Al2O3); гидратные соединения – от типичного основания (NaOH) к типичной кислоте (HClO4), через амфотерные (Al(OH)3, HAlO2).
Сущность явления периодичности – с возрастанием заряда ядра атомов периодически повторяются сходные свойства элементов, атомы которых имеют одинаковое число валентных электронов.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА – графическое изображение периодического закона. Всего 7 периодов и 8 групп.
ПОЛЯРНОСТЬ МОЛЕКУЛ
характеризуется значением электрического момента
диполя (![]() ),
который равен векторной сумме электрических моментов диполей связей, имеющихся в
молекуле. Электрический момент диполя связи равен произведению длины диполя (l)
на эффективный заряд (
),
который равен векторной сумме электрических моментов диполей связей, имеющихся в
молекуле. Электрический момент диполя связи равен произведению длины диполя (l)
на эффективный заряд (![]() ):
):
![]() l·
l·![]()
Симметричные линейные, треугольные, тетраэдрические, октаэдрические молекулы неполярны.
ПОСТОЯННАЯ АВОГАДРО – см . моль.
ПРАВИЛО ВАНТ - ГОФФА: При повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза.
![]() ,
,
,
где
![]() -
температурный коэффициент реакции. Например, если
-
температурный коэффициент реакции. Например, если
![]() ,
то при увеличении температуры на 40 градусов скорость реакции возрастет в 16
раз:
,
то при увеличении температуры на 40 градусов скорость реакции возрастет в 16
раз:![]()
ПРИНЦИП ЛЕ ШАТЕЛЬЕ: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию реагирующих веществ), равновесие сместится в сторону той реакции (прямой или обратной), которая ослабляет это воздействие.Например, при повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении – в сторону экзотермической реакции.При увеличении концентрации исходных веществ или при удалении продуктов равновесие смещается в сторону образования продуктов реакции.При повышении давления равновесие смещается в сторону реакции, ведущей к уменьшению объема. (Изменение давления вызывает смещения равновесия только в реакциях с участием газообразных веществ).
ПРОТОН – стабильная элементарная частица, обладающая положительным электрическим зарядом, относительной массой, равной единице, входящая в состав атомного ядра. Число протонов равно порядковому (атомному) номеру элемента.
РАВНОВЕСИЕ ХИМИЧЕСКОЕ ДИНАМИЧЕСКОЕ – состояние системы, при котором скорость прямой и обратной реакции равны. Концентрации компонентов в этом случае называются равновесными. Смещение химического равновесия см. принцип Ле Шателье.
РАСТВОР – гомогенная физико-химическая система, состоящая из двух или более компонентов. Компоненты раствора – растворитель, растворенные вещества и продукты их взаимодействия. Различают растворы жидкие, твердые (сплавы), газообразные (например, воздух). Раствор с низким содержанием растворенного вещества называется разбавленным, с высоким содержанием растворенного вещества – концентрированным.
РАСТВОРИМОСТЬ – характеристика способности вещества растворятся в том или ином растворителе.
В зависимости от способности растворяться в воде вещества делятся на хорошо растворимые (нитраты, соли щелочных металлов), малорастворимые (азот, кислород, гидроксиды Ca и Mg) и практически нерастворимые (благородные газы, золото).
Растворимость веществ зависит от их природы, от температуры и давления. Растворимость твердых веществ с увеличением температуры, как правило, возрастает. Растворимость газов увеличивается с повышением давления и уменьшается с повышением температуры.
Раствор, в котором содержание растворяемого вещества точно соответствует его растворимости при данной температуре, называется насыщенным. Насыщенный раствор находится в равновесии с осадком растворенного вещества.
Ненасыщенный раствор содержит меньше вещества, чем насыщенный.
В пересыщенном растворе содержание вещества превышает его растворимость при данной температуре. Пересыщенные растворы неустойчивы. Количественно растворимость характеризуется массой вещества, способной раствориться в 100 г растворителя при данной температуре.
РЕАКЦИИ РАЗЛОЖЕНИЯ – реакции, в результате которых из одного вещества образуется несколько новых веществ.
2KClO3=2KCl+3O2,
Cu(OH)2=CuO+H2O,
2Cu(NO3)2=2CuO+4NO2+O2.
РЕАКЦИИ СОЕДИНЕНИЯ – реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество.
C+O2=CO2,
CaO+H2O=Ca(OH)2,
CaCO3+CO2+H2O=Ca(HCO3)2.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ есть изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени.
![]() ,
,
![]() –
величина положительная, поэтому если в уравнении скорости учитывается изменение
концентрации исходных веществ, то в правой части уравнения ставят знак минус, т.
к. в этом случае с2 > с1.
–
величина положительная, поэтому если в уравнении скорости учитывается изменение
концентрации исходных веществ, то в правой части уравнения ставят знак минус, т.
к. в этом случае с2 > с1.
Скорость химической реакции зависит от природы реагирующих веществ, от концентрации (см. Закон действующих масс), от температуры (см. правило Вант-Гоффа), от присутствия катализатора, для твердых веществ – от величины поверхности.
СОЛИ:
а) средние – электролиты, при диссоциации которых в водном растворе образуются катионы металлов (или ионы аммония) и анионы кислотных остатков:
AlCl3⇆Al3++3Cl-,
NH4Cl⇆NH4++Cl-.
б) двойные – электролиты, образующие при диссоциации в водном растворе катионы двух разных металлов (или одного из них – катиона аммония) и аниона одной и той же кислоты:
KAl(SO4)2⇆K++Al3++2SO42-;
в) кислые – электролиты, образующие при диссоциации в водном растворе, кроме катионов металла и анионов кислотного остатка, катионы Н+:
NaHSO4⇆Na++HSO4-
HSO4- ⇆H++SO42-
![]() NaHSO4⇆Na++H++HSO4-.
NaHSO4⇆Na++H++HSO4-.
Кислые соли - продукты неполного замещения атомов водорода в молекулах двух- и многоосновных кислот: NaH2PO4, NaHSO4, KHCO3, К2HPO4.<<
NaOH+H2SO4(избыток)=NaHSO4+H2O.
г) комплексные – электролиты, которые при диссоциации образуют в водном растворе сложные (комплексные) ионы:
K[Al(OH)4]⇆K++[Al(OH)4]-, [Ag(NH3)2]Cl⇆[Ag(NH3)2]+++Cl-;
д) основные – электролиты, образующие при диссоциации в водном растворе, кроме катионов металлов и анионов кислотного остатка, гидроксид-ионы:
CaOHCl⇆CaOH++Cl-
CaOH+ ⇆Ca2++OH-
CaOHCl⇆Ca2++OH-+Cl-
Основные соли - продукты неполного замещения гидроксогрупп в молекулах двух - и многокислотных оснований:
Ca(OH)2+HCl=CaOHCl +H2О,(ИЗБЫТОК)
AlOHCl2, FeOHSO4, (Al(OH)2)2SO4, CuOHNO3.
СПИН – вращение электрона вокруг своей воображаемой оси, существует два противоположно направленных вращения. Два электрона могут обладать или одинаковым или противоположным спином: ¯¯ ( ↑↑) – электроны с параллельными спинами, ↑¯ - электроны с антипараллельными спинами.
СТЕПЕНЬ ОКИСЛЕНИЯ – условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются ионными, а само соединение состоит из ионов. Степень окисления может быть целым и дробным числом, может принимать положительное, отрицательное и нулевое значение. Например:
![]()
![]()
![]()
![]() ,
,![]()
![]()
![]()
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (С. АРРЕНИУС):
а) при растворении в воде электролиты распадаются на положительные ионы (катионы) и отрицательные – (анионы). Ионы в растворе взаимодействуют с молекулами воды (гидратация);
б) под действием постоянного электрического тока катионы движутся к катоду, а анионы – к аноду;
в) диссоциация – процесс обратимый. Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул:
![]() (100
%)
(100
%)
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ – количество выделенной или поглощенной в результате реакции теплоты .
![]() ХИМИЧЕСКАЯ
РЕАКЦИЯ – процесс, при котором происходит
превращение одних веществ в другие, отличающиеся от исходных составом и
свойствами. Химические реакции иначе называются химическими явлениями.
ХИМИЧЕСКАЯ
РЕАКЦИЯ – процесс, при котором происходит
превращение одних веществ в другие, отличающиеся от исходных составом и
свойствами. Химические реакции иначе называются химическими явлениями.
ХИМИЧЕСКАЯ СВЯЗЬ – взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
ХИМИЧЕСКОЕ УРАВНЕНИЕ – условная запись химической реакции посредством химических знаков и формул. Уравнения реакций составляют на основе закона сохранения массы веществ. Равенство атомов каждого элемента в левой и правой части уравнения достигается расстановкой коэффициентов перед формулами веществ. Коэффициенты эти называются стехиометрическими.
Например, реакция синтеза аммиака записывается химическим уравнением:
![]() .
.
ХИМИЧЕСКАЯ ФОРМУЛА – условная запись состава вещества посредством химических знаков и индексов. Индекс обозначает число атомов данного элемента и ставится внизу справа от знака элемента. Если простое вещество имеет немолекулярное строение, то его обозначают химическим знаком элемента: NH4NO3, H2O, O2, Fe, S.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – вид атомов с одинаковым положительным зарядом ядра. (В Периодической системе элементов Д.И. Менделеева ему соответствует порядковый номер).
ХИМИЧЕСКИЕ ЯВЛЕНИЯ – см. химическая реакция.
ХИМИЯ – наука о веществах, составе, строении, свойствах и превращении одних веществ в другие.
ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ - реакции, протекающие с выделением теплоты. Например:H2 + Cl2 = 2HCl, ΔH =−184,6 кДж.
ЭЛЕКТРОЛИЗ – совокупность окислительно-восстановительных процессов, происходящих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
Электролизер – ячейка для электролиза, состоящая из двух электродов и электролита. Электроды могут быть металлические и неметаллические (графитовые). Катод – отрицательно заряженный электрод, на котором происходит реакция восстановления. В зависимости от положения металла в ряду напряжений возможны следующие процессы:
|
Li–Al (включительно) |
2H2O+2 |
|
Al – H |
2H2O+2
|
|
H -Au |
|
Анод – положительно заряженный электрод, на котором протекает реакция окисления. Металлические аноды могут быть: а) нерастворимыми, или инертными (Pt, Au, Ir), при электролизе служат лишь передатчиком электронов; б) растворимыми или активными (Cu, Zn, Ni, и др.), при электролизе окисляются. Анодные процессы зависят от типа аниона:
|
Анионы бескислородных кислот |
An--nē=A
|
|
Анионы кислородсодержащих кислот |
2H2O-4ē= =O2+4H+ |
|
Пример 1. Электролиз расплава BaCl2 |
Пример 2. Электролиз раствора CuSO |
 |

|
ЭЛЕКТРОЛИТЫ СИЛЬНЫЕ – степень диссоциации > 80 %, это растворимые соли (Na2SO4,KCl, Ca(NO3)2), сильные основания (NaOH, KOH, Ba(OH)2), сильные кислоты (HNO3, H2SO4, HCl).
ЭЛЕКТРОЛИТЫ СЛАБЫЕ – степень диссоциации < 3 %, к ним относятся слабые кислоты (H2S, H2SO3, CH3COOH, H2SiO3), слабые основания (NH4OH).
ЭЛЕКТРОН – стабильная элементарная частица, несущая отрицательный электрический заряд, число электронов в оболочке атома равно числу протонов в ядре атома.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ – запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням:
1s22s22p63s23p64s23d10 4p65s24d105p66s25d14f14 5d2-106p67s26d15f146d2-107p6.
ЭЛЕКТРОННОЕ ОБЛАКО – область, в пределах которой вероятность нахождения электрона велика (превышает 90 %).
s – электронные облака имеют сферическую форму, на s-орбитали находится не более двух электронов, спины которых антипараллельны. s-элементы – элементы I-II групп главных подгрупп, включая водород и гелий.
p – электронные облака имеют гантелеобразную форму, они располагаются в трех взаимно перпендикулярных направлениях. На данном энергетическом уровне может находиться от одного до шести p-электронов. p-элементы – элементы III-VIII групп главных подгрупп.
d – электронные облака имеют сложную форму, их может быть в атомах от одного до десяти на пяти d-орбиталях с противоположно направленными спинами. d-элементы – элементы I-VIII групп побочных подгрупп.
f –электронные облака, располагающиеся по семи различным направлениям, их может быть до 7. f-элементы – элементы с №58-71-лантаноиды, №90-103-актиноиды.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ – способность атома оттягивать на себя электроны при образовании химической связи. Сверху вниз электроотрицательность уменьшается; по периоду слева направо увеличивается, так как радиус атома слева направо уменьшается, число электронов на внешнем уровне увеличивается, притяжение электронов внешнего уровня к ядру усиливается.
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ – расположение металлов по уменьшению их восстановительной активности:
Li, K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pb, H, Cu, Ag, Pt, Aи.
В ряд напряжений помещен также водород, который, как и металлы, отдает электрон, образуя положительно заряженный ион. На основании ряда напряжений можно сделать три основных заключения о химическом поведении металлов: 1) каждый металл, кроме щелочных металлов, вытесняет из растворов солей другие металлы, расположенные в ряду напряжений правее него и может быть сам вытеснен металлами, расположенными левее
Zn+CuCl2=Cu+ZnCl2,
Zn+Cu+2=Cu+Zn+2;
2) металлы расположенные левее водорода, вытесняют его из растворов кислот (кроме HNO3), а расположенные правее не вытесняют
Zn+2HCl=ZnCl2+H2,
Zn+2H+=Zn+2+H2
Cu+HCl¹
3) чем левее находится металл, тем он активнее, тем более сильным восстановителем он является, и тем труднее восстанавливаются его ионы.
ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ – реакции, протекающие с поглощением тепла. Например: N2 + O2 = 2NO, ∆H = 180,6 кДж.
ЭНЕРГИЯ ИОНИЗАЦИИ – энергия, которую необходимо затратить, чтобы удалить один электрон внешнего уровня на бесконечно далекое расстояние от ядра. В главных подгруппах сверху вниз уменьшается энергия ионизации, так как увеличивается радиус атома и притяжение между электронами внешнего уровня и ядром ослабевает. По периоду радиус атома уменьшается, и энергия ионизации увеличивается.
ЭНЕРГИЯ СВЯЗИ – количество энергии, выделяющейся при образовании химической связи.
ЭФФЕКТИВНЫЙ ЗАРЯД – заряд, возникающий на атоме вследствие смещения электронной пары к одному из ядер взаимодействующих атомов.
ЯДРО – центральная часть атома, заряженная положительно, в нем сосредоточена основная масса атома. Ядро состоит из нуклонов (протонов и нейтронов).
До новых встреч, друзья!